Epothilon - Grundinformationen
-> hemmende Wirkung auf Krebszellen
Vergleichbar: Taxol (aus pazifischer Eibe) oder Sagophilon (Bayer-Schering)

R=H : Epothilon A
R=Me: Epothilon B
Vergleichbar: Taxol (aus pazifischer Eibe) oder Sagophilon (Bayer-Schering)

R=H : Epothilon A
R=Me: Epothilon B
Rule of Five?
1.) Molekülmasse ist nicht mehr als 500g/mol
2.) Das Molekül hat nicht mehr als 5 Donatoren (OH, NH, .... )
3.) Das Molekül hat nicht mehr als 10 Akzeptoren (O, N, ... )
4.) Verteilungskoeffizient zwischen Ocatanol/Wasser (log P) liegt zwischen -2 & 5
-> Trifft nicht immer zu: Taxol fällt heraus, ist jedoch hoch-wirksam!
2.) Das Molekül hat nicht mehr als 5 Donatoren (OH, NH, .... )
3.) Das Molekül hat nicht mehr als 10 Akzeptoren (O, N, ... )
4.) Verteilungskoeffizient zwischen Ocatanol/Wasser (log P) liegt zwischen -2 & 5
-> Trifft nicht immer zu: Taxol fällt heraus, ist jedoch hoch-wirksam!
Allg. Ablauf einer Wittig Reaktion?


Bildung des Olefins über Vierring (C1-O-P-C2-C1), das Oxaphosphan.
cis-selektive Wittig Reaktion?

- Salzfreies Arbeiten: Keine Benutzung von Li als Base
=> Alternativen sind: KOtBu, KHMDS, NaNH2
trans-selektive Wittig Reaktion mit Alkylen?
-> sogenannte Schlosser Variante (nicht salzfrei!!)


Horner-Wodsworth-Emmons?
- Reaktion mit ß-Keto & ß-(Alkoxycarbonyl)phosphorsäuredialkylester (Li, Na, K - Salze)
=> a,ß - ungesättigte Ketone & Ester

=> trans (E-selektiv)
=> a,ß - ungesättigte Ketone & Ester

=> trans (E-selektiv)
Still-Gennar
=> cis (Z)-selektive Reaktion mithilfe von Kronenether-Kalium Komplexe als Katalysator


Synthese von Sagophilon nah Bayer - Schering

=> Problem: Herstellung von Z-Olefin:E-Olefin im 1:1 Maßstab -> aufwendige und teure Aufreinigung.
Julia-Kocienski Olefinierung?

=> Einsatz einer Li-Base: Bildung eines Li-Chelaten im 2. Schritt -> Z
=> Einsatz einer anderen Base: Nicht-Chelat -> E
Metathese Reaktion?
Nobel Grubbs, Schrock
Chavin
Edukte = Olefine
=> Kreuzmetathese, ebenfalls intramolekuler Metathese möglich
Chavin
Edukte = Olefine
=> Kreuzmetathese, ebenfalls intramolekuler Metathese möglich
Olefinbildungssynthesen?
- Wittig- Reaktion
- Horner-Wodsworth-Emmons
- Still-Gennar
- Peterson-Olefinierung
- Julia-Kocienski Olefinierung
- Carbometallierung
- Hydroborierung
- Tebbe- Olefinierung (Methylenierung)
- Metathese Reaktion
- Horner-Wodsworth-Emmons
- Still-Gennar
- Peterson-Olefinierung
- Julia-Kocienski Olefinierung
- Carbometallierung
- Hydroborierung
- Tebbe- Olefinierung (Methylenierung)
- Metathese Reaktion
Epoxidierung mithilfe von Persäuren?
Nachteil: Persäuren sind meistens hochexplosiv!!


Sharpless Epoxidierung?
- Eine Einbringung in den Herstellungsprozess von Indinavir (Anti-AIDS) ist am Patent gescheitert => Racematspaltung günstiger


Sauerstoffübertragungen
- Epoxidierung mithilfe einer Persäure
- Epoxidierung mithilfe von NBS
- Sharpless
- ....
- Epoxidierung mithilfe von NBS
- Sharpless
- ....
Tags: ToDo
Quelle:
Quelle:
Stereochemie und die Anwendung auf Epothilon
- chiral
- enantiomerenrein
- 7 stereogene Zentren
=> Diastereomere

- enantiomerenrein
- 7 stereogene Zentren

=> Diastereomere

Was ist ein chiral Pool?
- Aminosäuren liegen in der Natur oft Enantiomerenrein vor: Verwendung als Grundbaustein:


Asymmetrische Synthese mithilfe des CBS-Katalysators

Die Umsetzung mit
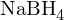 führt zu einem racemischen Gemisch!
führt zu einem racemischen Gemisch!Der CBS Katalysator ist auf der Basis von Prolin entstanden.
Asymmetrische Synthese mithilfe von Substratinduktion?

Induktion kann auch über weitere Strecken erfolgen, z.B. eine 1,5 - Induktion, jedoch ist diese Induktion meist um ein vielfaches schwächer.
Wirkung von Enantiomeren?
- Enantiomere können verschiedene Wirkungen haben:
- Limonen: R-(+): Orangenduft
S-(-): Terpengeruch
- Menthol: (-): kühlende Wirkung
(+): muffiger Geruch
Bekanntestes Beispiel:
Contergan!!
- Limonen: R-(+): Orangenduft
S-(-): Terpengeruch
- Menthol: (-): kühlende Wirkung
(+): muffiger Geruch
Bekanntestes Beispiel:
Contergan!!
Begriffsklärung: Arten von Chiralität?
- stereogene Zentren (wichtig: nicht nur C, sondern auch, P, S, N, ...)
- axiale Chiralität (bei Binol)
- planare Chiralität (einfach subst. Feroccen)
- helikale Chiralität (Drehrichtung, z.B. DNA)
- axiale Chiralität (bei Binol)
- planare Chiralität (einfach subst. Feroccen)
- helikale Chiralität (Drehrichtung, z.B. DNA)
Begriffsklärung: Arten von Isomeren?
- Konstitutionsisomere (gleiche Summenformel, andere Struktur)
=> sehr bekannt hier: Keto-Enol Tautomerie
- Stereoisomere
- Konformationsisomere (können durch Drehung an einer Bindung ineinander überführt werden)
- Konfigurationsisomere
=> Enantiomere/ Diastereomere
-
=> sehr bekannt hier: Keto-Enol Tautomerie
- Stereoisomere
- Konformationsisomere (können durch Drehung an einer Bindung ineinander überführt werden)
- Konfigurationsisomere
=> Enantiomere/ Diastereomere
-
Begriffsklärung: Definition des Drehwerts?
gemessener Drehwert: 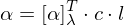

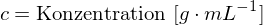

Das Lösungsmittel hat außerdem ebenfalls einen erheblichen Einfluß auf den Drehwert.
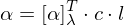

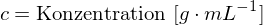

Das Lösungsmittel hat außerdem ebenfalls einen erheblichen Einfluß auf den Drehwert.
Begriffsklärung: Was bedeutet ee?
ee ist wie folgt definiert:

Dies funktioniert jedoch nur bei linearem Zusammenhang zwischen c und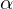

Dies funktioniert jedoch nur bei linearem Zusammenhang zwischen c und
Nomenklatur chiraler Verbindungen?
- absolute Konfiguration
- Fischer Nomenklatur
- Cahen- Ingold-Prelog- Nomenklatur (CIP-Regeln)
- Fischer Nomenklatur
- Cahen- Ingold-Prelog- Nomenklatur (CIP-Regeln)
Begriffsklärung: CIP-Regeln
- Zentralatom: 4 Substituenten a,b,c,d
- Molekül so anordnen, dass das niedrigeste von der OZ nach hinten steht (d)
=> im Uhrzeigersinn a->b->c->d => R
=> gegen Uhrzeigersinn a->b->c->d => S
Prioritätsregeln
1.) Ordnungszahl ( O > N > C > H )
2.) falls 1. Position identisch: Kette weiter folgen
3.) Doppel-/Dreifachbindungen: Betrachtung wie 2 bzw. 3 Bindungen.

- Molekül so anordnen, dass das niedrigeste von der OZ nach hinten steht (d)
=> im Uhrzeigersinn a->b->c->d => R
=> gegen Uhrzeigersinn a->b->c->d => S
Prioritätsregeln
1.) Ordnungszahl ( O > N > C > H )
2.) falls 1. Position identisch: Kette weiter folgen
3.) Doppel-/Dreifachbindungen: Betrachtung wie 2 bzw. 3 Bindungen.

Stereochemie
- Anwendung auf Epothilon
- chiral Pool (Aminosäuren)
- kinetische Racematspaltung
- Racematspaltung über enantiomerenreine Säure
- Asymmetrische Synthese
- CBS- Katalysatoren
- Substratinduktion
- enantiomerenreine Alkylierung nach Evans
- chiral Pool (Aminosäuren)
- kinetische Racematspaltung
- Racematspaltung über enantiomerenreine Säure
- Asymmetrische Synthese
- CBS- Katalysatoren
- Substratinduktion
- enantiomerenreine Alkylierung nach Evans
Der Zimmerman-Traxler Übergangszustand

=> Erfoderlich: Chelatbildenes Metall, ansonsten Open transistion State -> E-Enolat => syn Produkt
=>Funktioniert mit Ketonen, Estern, Amiden, ...
Allyladdition nach ZImmerman- Traxler

Mithilfe des Zimmerman-Traxler Übergangs kann man nicht nur Aldolreaktionen erklären, Allyladditionen lassen sich sehr ähnlich erklären.
Aldolreaktionen
- Zimmerman-Traxler Übergangszustand
- Änderung der Absolutkonfiguration nach Evans
- Katalytische Verfahren (Carreira, Evans)
- Synthese mithilfe von Oganokatalyse
- Enamin Mechanismus
- Synthese nach Schinzer
- Synthese nach Nicolaou
- Synthese nach Schering
- Änderung der Absolutkonfiguration nach Evans
- Katalytische Verfahren (Carreira, Evans)
- Synthese mithilfe von Oganokatalyse
- Enamin Mechanismus
- Synthese nach Schinzer
- Synthese nach Nicolaou
- Synthese nach Schering
Überblick Nomenklatur von Heterozyklen
- systematische Namen => analoge Kohlenstoffverbindungen
- Trivialnamen + syst. Namen
=> Hantzsch- Widmann Nomenklatur
bestehend aus einem Präfix (Heteroatom) und einem Suffix (Art, Größe & Ringsystem)
- Trivialnamen + syst. Namen
=> Hantzsch- Widmann Nomenklatur
bestehend aus einem Präfix (Heteroatom) und einem Suffix (Art, Größe & Ringsystem)
Hantzsch-Widman Nomenklatur - Präfixe
| Element | Präfix | Element | Präfix |
| O | oxa | Sb | stiba |
| S | thia | Bi | bisma |
| Se | selena | Si | sila |
| Te | tellura | Ge | germa |
| N | aza | Sn | stanna |
| P | phospha | Pb | plumba |
| As | arsa | B | bora |
| Hg | Mercua |
Hantzsch-Widman Nomenklatur: Suffixe für N-haltige Systeme
| N-haltig | N-frei | |||
| Ring | Stammverb. | gesättigt | Stammverb. | gesättigt |
| 3 | irin | iridin | iren | iran |
| 4 | et | etidin | et | etan |
| 5 | ol | olidin | ol | olan |
| 6 | in | an | ||
| 7 | epin | epan | ||
| 8 | ocin | ocan | ||
| 9 | onin | onan | ||
| 10 | ecin | ecan |
Hantzsch - Widman Nomenklatur: Regeln
- Präfix wird in Reihenfolge der Tabelle vergeben
- bei gleichem Typ: "Di", "Tri"
- Nummerierung beginnt bei dem Heterogenatom, dass in der Tabelle am höchsten steht.
wenn bei Präfix und Suffix zwei Vokale aufeinander treffen, wird aus Gründen der Aussprache der Vokal aus dem Präfix entfernt.
Teilweise gesättigte Systeme:
- dihydro, tetrahydro, perhydro, ....
=> Tetrahydrofuran
=> 1,4-Dihydropyridin ( zwei Doppelbindungen von 2-3 & 4-5)
- bei gleichem Typ: "Di", "Tri"
- Nummerierung beginnt bei dem Heterogenatom, dass in der Tabelle am höchsten steht.
wenn bei Präfix und Suffix zwei Vokale aufeinander treffen, wird aus Gründen der Aussprache der Vokal aus dem Präfix entfernt.
Teilweise gesättigte Systeme:
- dihydro, tetrahydro, perhydro, ....
=> Tetrahydrofuran
=> 1,4-Dihydropyridin ( zwei Doppelbindungen von 2-3 & 4-5)
Hantsch- Synthese

=> IN der Heterocyclensynthese werden häufig HCl oder Wasser abgespalten:
=>kleine stabile Moleküle
Elektrophile Substitution an Heterocyclen
Heterocyclen sind weniger aktiv: => fehlende Elektronendichte
=>extreme Bedingungen nötig, da Ring elektronenarm

=>extreme Bedingungen nötig, da Ring elektronenarm

Nucleophile Substitution an Heterocyclen?
1,3-Azole sind sehr elektronenarm
=> Nucleophile Substitution stark erleichter

=> Nucleophile Substitution stark erleichter

Makrolaktonisierung - Prinzip?

- mittlere Ringe (
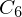 -
- ) sind sehr schwer
) sind sehr schwer- große Ringe (
 - C_{...}##) sind schwer
- C_{...}##) sind schwer=> große Verdünnung, Chelateffekte (um Krümmung hinzukriegen)







































