Aus welcher mit Hilfe der Schrödinger-Gleichung berechneten Größe erhält man Informationen über die räumliche Gestalt der Elektronenwolke?
Aus der Aufenthaltswarscheinlichkeit. (Das Quadrat der Wellenfunktion  ). Man kann die Ladung nicht als Teilchen sehen sondern eher als "verschmierte" Ladung sehen.
). Man kann die Ladung nicht als Teilchen sehen sondern eher als "verschmierte" Ladung sehen.
 ). Man kann die Ladung nicht als Teilchen sehen sondern eher als "verschmierte" Ladung sehen.
). Man kann die Ladung nicht als Teilchen sehen sondern eher als "verschmierte" Ladung sehen.Tags: Atomphysik
Source: Skript 6/18
Source: Skript 6/18
Wie groß ist jeweils das Verhältnis der Radien der Bohr'schen Bahnen vor und nach dem Übergang?
Balmer-Linie (Übergang
(Übergang 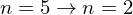 ) und der Lyman-Linie
) und der Lyman-Linie  (Übergang
(Übergang  )
)
Balmer-Linie
 (Übergang
(Übergang 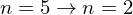 ) und der Lyman-Linie
) und der Lyman-Linie  (Übergang
(Übergang  )
)
also Wasserstoff
 und
und  krüzt sich.
krüzt sich.also

Andere Erklärung:



Mit
 für Wasserstoff:
für Wasserstoff:

 und
und 
Tags: Atomphysik
Source: Skript 6/6
Source: Skript 6/6
Welche Energie (in eV) muß aufgewendet werden, um bei einem bereits zweifach ionisierten Lithium-Atom(Z=3) auch das letzte Elektron zu entfernen?



Tags: Atomphysik
Source: Skript 6/5 6/9
Source: Skript 6/5 6/9
Welche räumliche Verteilung der Ladungsdichte liegt im Wasserstoffatom vor, wenn die Hauptquantenzahl n=1 ist (unterscheiden Sie zwischen azimutaler und radialer Ladungsdichteverteilung)?
Azimuntal: Kugel
Radial: Ein Maximum beim Bohr'schen Radius und klingt nach außen exponentiell ab
und klingt nach außen exponentiell ab
Radial: Ein Maximum beim Bohr'schen Radius
 und klingt nach außen exponentiell ab
und klingt nach außen exponentiell abTags: Atomphysik
Source: Skript 6/20; http://matheplanet.com/matheplanet/nuke/html/viewtopic.php?topic=94744
Source: Skript 6/20; http://matheplanet.com/matheplanet/nuke/html/viewtopic.php?topic=94744
Niels Bohr konnte 1913 die Spektralserien des Wasserstoff-Atoms theoretisch deuten. Dazu musste er zwei Postulate verwenden, die die klassische Physik außer Kraft setzten. Wie lauten diese Postulate und in welcher Weise widersprechen sie der klassischen Physik?
1.) Postulat: die Elektronen bewegen sich in einer Kreisbahn um den Atomkern. Nach der Klassischen Physik müsste es dabei Energie verlieren und in den Kern fallen.
2.) Postulat: ein Elektron kann von höherer Bahn in eine Niedrigere springen, dabei wird ein Lichtquant mit der Differenz der Bahnenergien emittiert, umgekehrt eines absorbiert. In der Klassischen Physik müsste das Elektron in der Umlauffrequenz abstrahlen.
2.) Postulat: ein Elektron kann von höherer Bahn in eine Niedrigere springen, dabei wird ein Lichtquant mit der Differenz der Bahnenergien emittiert, umgekehrt eines absorbiert. In der Klassischen Physik müsste das Elektron in der Umlauffrequenz abstrahlen.
Tags: Atomphysik
Source: Skript 6/4
Source: Skript 6/4
Erklären Sie den Stern-Gerlach-Versuch. Was kann man aus dem Ergebniss lernen?
In diesem Versuch wurde ein Silberatomstrahl in einem inhomogenen Magnetfeld abgelenkt.
Klassisch hätte sich ein verwaschener Fleck am Auffangschirm bilden müssen, da jede Einstellung des magnetischen Moments der Ag-Atome relativ zum Magnetfeld möglich ist.
Nach der Sommerfeldschen Theorie (ohne Spin) hätte sich der Atomstrahl in 1,3,5... Teilstrahlen aufspalten müssen (nach L ... Drehimpuls).
Aber da sich der Atomstrahl in nur zwei Teilstrahlen aufspaltete, hatte man einen Beweis für halbzahlige Drehimpulse, den Spin und für die Richtungsquantelung.
Es gibt 2 Möglich Orientierungen in einem äußeren Feld:
 und
und 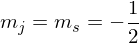
Klassisch hätte sich ein verwaschener Fleck am Auffangschirm bilden müssen, da jede Einstellung des magnetischen Moments der Ag-Atome relativ zum Magnetfeld möglich ist.
Nach der Sommerfeldschen Theorie (ohne Spin) hätte sich der Atomstrahl in 1,3,5... Teilstrahlen aufspalten müssen (nach L ... Drehimpuls).
Aber da sich der Atomstrahl in nur zwei Teilstrahlen aufspaltete, hatte man einen Beweis für halbzahlige Drehimpulse, den Spin und für die Richtungsquantelung.
Es gibt 2 Möglich Orientierungen in einem äußeren Feld:
 und
und 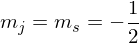
Tags: Atomphysik
Source: Skript 6/50
Source: Skript 6/50
Die Rydbergkonstante für das Wasserstoffatom beträgt 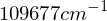 . Wie groß ist die Ionisierungsenergie in der Einheit eV?
. Wie groß ist die Ionisierungsenergie in der Einheit eV?
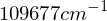 . Wie groß ist die Ionisierungsenergie in der Einheit eV?
. Wie groß ist die Ionisierungsenergie in der Einheit eV?

Tags: Atomphysik
Source: Skript 6/9
Source: Skript 6/9
Die Rydbergkonstante ist 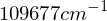 Welche Energie (in eV) muß aufgewendet werden, um bei einem bereits dreifachen ionisierten Beryllium-Atom (Z=4) auch das letzte Elektron zu entfernen?
Welche Energie (in eV) muß aufgewendet werden, um bei einem bereits dreifachen ionisierten Beryllium-Atom (Z=4) auch das letzte Elektron zu entfernen?
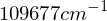 Welche Energie (in eV) muß aufgewendet werden, um bei einem bereits dreifachen ionisierten Beryllium-Atom (Z=4) auch das letzte Elektron zu entfernen?
Welche Energie (in eV) muß aufgewendet werden, um bei einem bereits dreifachen ionisierten Beryllium-Atom (Z=4) auch das letzte Elektron zu entfernen?
 für eV
für eV 
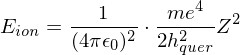

Tags: Atomphysik
Source: Physik-Duden, http://www.chemieonline.de/forum/showthread.php?t=163087, Skriptum 6./9
Source: Physik-Duden, http://www.chemieonline.de/forum/showthread.php?t=163087, Skriptum 6./9
Welche Atommodelle wurden besprochen? Geben Sie die zugrundeliegenden Ideen an. In welchen Bereichen der Physik verwendet man diese Modelle (oft stillschweigend) heute?
- Rosienenkuchenmodell * Gleichmäßige verteilung von Elektronen und Protonen
- Dynamidenmodell * Man schloss aus Kathodenstrahlenexperimenten das es viel freien Raum gibt
- Rutherford * Goldfolienexperiement Teilchem müssen einen konzenztrierten Punkt haben
- Bohr * Erweitertes Rutherford-Modell * Postulate * Beschleunigte Kreisbewegung. Darf nach klassischer Physik nicht sein, weil müsste Energie abgeben. * Beim Übergang zwischen höheren Energiebahn zu niedriger wird ein Lichtquant emittiert. (Andersrum absorbiert). Klassisch müsste es Licht abstrahlen mit
Tags: Atomphysik
Source: Skript 6/4
Source: Skript 6/4
Wie werden Elektronen in eine Teilschale (z.B. 3p). eingefügt, wenn man im Periodensystem von einem Element zum nächsten weitergeht?
Pauli-Prenzip: Orbitale Gleicher Energie zuerst einfach, dann doppelt.
Tags: Atomphysik
Source: http://de.wikipedia.org/wiki/Elektronenkonfiguration
Source: http://de.wikipedia.org/wiki/Elektronenkonfiguration
Wie werden die chemischen Elemente im Periodensystem eingeordnet (Bohr'sches Aufbauprinzip)?
Von einem Element zum Nächsten wird jeweils ein Elektron und ein Proton(eventuell ein Neutron als "Kitt") hinzugefügt.
Dabei muss das Pauliprinzip berücksichtigt werden: Wenigstens eine der 4 Quantenzahlen des neuen Elektrons muss sich von den bereits vergebenen unterscheiden( ).
).
Elektronen mit gleicher Hauptquantenzahl fasst man in einer Schale zusammen.
Dabei muss das Pauliprinzip berücksichtigt werden: Wenigstens eine der 4 Quantenzahlen des neuen Elektrons muss sich von den bereits vergebenen unterscheiden(
 ).
).Elektronen mit gleicher Hauptquantenzahl fasst man in einer Schale zusammen.
Tags: Atomphysik
Source: Skript 6/48 (M: 6/44)
Source: Skript 6/48 (M: 6/44)
Welche Versuche führten zum Rutherford'schen Atommodell?
Rutherford führte Streuversuche mit α-Teilchen an dünnen Folien durch und beobachtete, dass nur selten eine Ablenkung um große Winkel erfolgt. Daraus konnte er folgern, dass die positive Ladung an einer Stelle im Atom konzentriert sein muss (Radius ca.  cm). Dies führte zur Entstehung des Begriffs Atomkern. Um den Experimentell bekannten Atomradius (ca.
cm). Dies führte zur Entstehung des Begriffs Atomkern. Um den Experimentell bekannten Atomradius (ca.  cm) zu erklären, ordnete er die Elektronen auf Bahnen weit außerhalb des Kerns an.
cm) zu erklären, ordnete er die Elektronen auf Bahnen weit außerhalb des Kerns an.
 cm). Dies führte zur Entstehung des Begriffs Atomkern. Um den Experimentell bekannten Atomradius (ca.
cm). Dies führte zur Entstehung des Begriffs Atomkern. Um den Experimentell bekannten Atomradius (ca.  cm) zu erklären, ordnete er die Elektronen auf Bahnen weit außerhalb des Kerns an.
cm) zu erklären, ordnete er die Elektronen auf Bahnen weit außerhalb des Kerns an.Tags: Atomphysik
Source: Skript 6/2
Source: Skript 6/2
Welche Energie (in eV) muss ein Photon mindestens besitzen, damit es sich (in Anwesenheit eines Atomkerns) in ein Elektron und ein Positron verwandeln kann (sog. "Paarerzeugung")?

Tags: Atomphysik
Source: Skript 6/70
Source: Skript 6/70
Wie viele Elektronen können sich in einer voll gefüllten Schale mit Hauptquantenzahl n aufhalten? Warum ist diese Zahl überhaupt begrenzt?
 ist durch den Grad der Entartung des Wasserstoff-Energieniveaus gegeben.
ist durch den Grad der Entartung des Wasserstoff-Energieniveaus gegeben.Tags: Atomphysik
Source: Skript 6/45
Source: Skript 6/45
Erklären Sie anhand der radialen Ladungsdichteverteilung der Elektronen, warum nach dem Element Argon zunächst die Elektronen in die 4s-Schale (Kalium) und nicht in die 3d-Schale eingebaut werden.
Nach dem das 4s Orbital ein nebenmaximum in Kernnähe hat, erfährt es dort ein weniger abgeschirmtes Coulomb-Potential.
Es liegt daher energietisch günstiger.
Es liegt daher energietisch günstiger.
Tags: Atomphysik
Source: Skript 6/22
Source: Skript 6/22
Erklären Sie anhand der radialen Ladungsdichteverteilung der Elektronen, warum nach dem Element Krypton zunächst die Elektronen in die 5s-Schale (Rubidium) und nicht in die 4d-Schale eingebaut werden.
Nach dem das 5s Orbital ein nebenmaximum in Kernnähe hat, erfährt es dort ein weniger abgeschirmtes Coulomb-Potential.
Es liegt daher energietisch günstiger.
Es liegt daher energietisch günstiger.
Tags: Atomphysik
Source: Skript 6/22
Source: Skript 6/22
Mit welcher Spinanordung werden Elektronen in eine Teilschale (z.B. 4p) eingefügt, wenn man von einem Element zum nächsten weitergeht?
Immer zuerst mit dem UP-Spin, dann mit Down-Spin (Pauli)
ergänz this
ergänz this
Tags: Atomphysik
Source: Skript 6/45
Source: Skript 6/45
Erklären Sie den Unterschied zwischen spontaner und induzierter Emission.
Besetzungsinversion ist die voraussetzung
Spontan: Nicht vorhersehbar.
Stimulierte: Ein Photon im angeregten zustand wird mit einem Strahlungfeld stimuliert und emittiert ein identisches Photon wieder ab.

Spontan: Nicht vorhersehbar.
Stimulierte: Ein Photon im angeregten zustand wird mit einem Strahlungfeld stimuliert und emittiert ein identisches Photon wieder ab.

Tags: Atomphysik
Source: Skript 6/59 (M: 6/55)
Source: Skript 6/59 (M: 6/55)
Werden die Schalen streng nach steigender Haupt- und Bahnquantenzahl gefüllt oder sind weitere Gesichtspunkte zu berücksichtigen?
Ladungsdichtepotential! Pauli!
Tags: Atomphysik
Source:
Source:
Flashcard set info:
Author: Julian
Main topic: Physik
Topic: Physik TE
School / Univ.: Technische Universität
City: Graz
Published: 02.03.2014
Card tags:
All cards (90)
Atomphysik (20)
Grundlagen (1)
Kernphysik (9)
Laser (3)
Linsensysteme (1)
Mechanik (10)
Newton (1)
Optik (3)
Quantenphysik (3)
Quantenzahlen (1)
Radioaktivität (1)
Röntgen (1)
Röntgenstrahlung (1)
Schiefer Wurf (1)



